近日,上海交通大学教授凌代舜联合浙江大学和杭州医学院的合作者,研发出一款仿噬菌体的抗菌纳米酶——刺突结构中空氧化锰纳米酶。

在激光照射之下,氧化锰纳米酶可以对抗金葡萄球菌生物膜感染、抑制炎症反应以及促进血管生成,进而可以促进耐药菌感染的伤口修复和再生,并且其具备安全、高效的优势。

实验结果显示,对于细菌生物膜导致的感染,氧化锰纳米酶具有明显的感染清除效果。并且,因其具良好的生物相容性,可有效促进组织的修复与再生,包括耐药生物膜感染导致的难治性伤口的修复等。此外,氧化锰纳米酶可被近红外光调控,由于近红外光的组织穿透性较强,故其也有望用于深部组织的生物膜感染清除与损伤修复。
据介绍,课题组的前期目标是针对耐药细菌感染伤口的难愈合问题,研发一种新型纳米酶,以对感染部位的细菌生物膜进行穿透,进而实现高效抗菌的效果。纳米酶可通过原位催化的方式,模拟氧化酶和过氧化酶等的催化作用,生成活性氧杀伤细菌。但是,生成的活性氧的扩散半径较小、半衰期较短,限制了纳米酶的抗菌效果。
以此为目标,受天然噬菌体表面刺突结构的启发,他们成功合成一种新型氧化锰纳米酶,其表现呈现刺突结构,结构上模拟噬菌体以提高粘附性,并且具备优异的催化性能。
课题组通过实验发现,这种刺突结构纳米酶可以很好地粘附并杀伤浮游致病菌,但是对于生物膜的杀伤效果还不够好。
究其原因,他们发现这些刺突结构纳米酶难以渗透进入致密的细菌生物膜。通过调研文献,该团队发现尺寸小而光滑的纳米粒,往往能够很好地渗入细菌生物膜。
由此他们猜想,氧化锰纳米酶表面的刺突结构,虽然能够帮助纳米酶粘附细菌并杀死细菌,但却抑制了纳米酶的细菌生物膜渗透效果。
为证明这一观点,他们在学习相关物理学原理的同时,着手设计相关的实验方案。最终,在理论和事实两种角度之上,课题组都找到了相关依据。
实验结果显示,相比表面粗糙的纳米颗粒,表面光滑的纳米颗粒很难粘附在细菌细胞表面,但是却能渗透生物膜,这一现象也符合布朗运动的规律。
完成上述探索之后,他们将研究目标进一步细化:力图解决抗菌纳米酶渗透性能与细菌粘附性能之间“鱼和熊掌不可兼得”的矛盾,设计一种可以同时实现细菌生物膜深部渗透与细菌粘附的纳米酶,借此实现纳米酶治疗效果的双重“放大”。
就这样,所有成员以终为始成功构建出氧化锰纳米酶,其外表模拟了噬菌体的刺突结构,内部呈现为中空状态,并搭载了光热试剂。
其优点在于:不仅能通过纳米酶的光热效应破坏生物膜,并且当其粘附在细菌表面之后,近红外光刺激可有效放大其催化活性,从而可作为一种细菌膜锚定的活性氧生成器。
杭州医学院吴海滨助理研究员、魏敏博士和胡深医师是共同一作;上海交通大学凌代舜教授、浙江大学李方园教授和杭州医学院梁广研究员担任共同通讯作者 [1]。

,是他们给这款氧化锰纳米酶起的名。研究中,课题组主要通过“牺牲模板”的方法制备了这种纳米酶。
在合成过程中,通过透射电子显微镜和高分辨率透射电子显微镜,他们对所有产物结构加以表征,证明 确实拥有类噬菌体刺突结构与中空结构,其表面多孔且粗糙,可以成功负载吲哚菁绿。
此后,通过动态光散射测试和 ζ 电位测试,课题组验证发现 能够稳定分散在水中、以及其他常见的生物介质中。
而后,通过 X 射线光电子能谱和 X 射线衍射测试,该团队又对 hMnOx 晶相结构与表面性质加以研究,确证 可以氧化谷胱甘肽并催化芬顿反应。

接着,他们又开展光增强的催化性能研究。由阿伦尼乌斯方程可知,化学反应的速率与反应温度呈正相关。通过克服活化势垒和提高传质速率,热能可以促进催化反应。
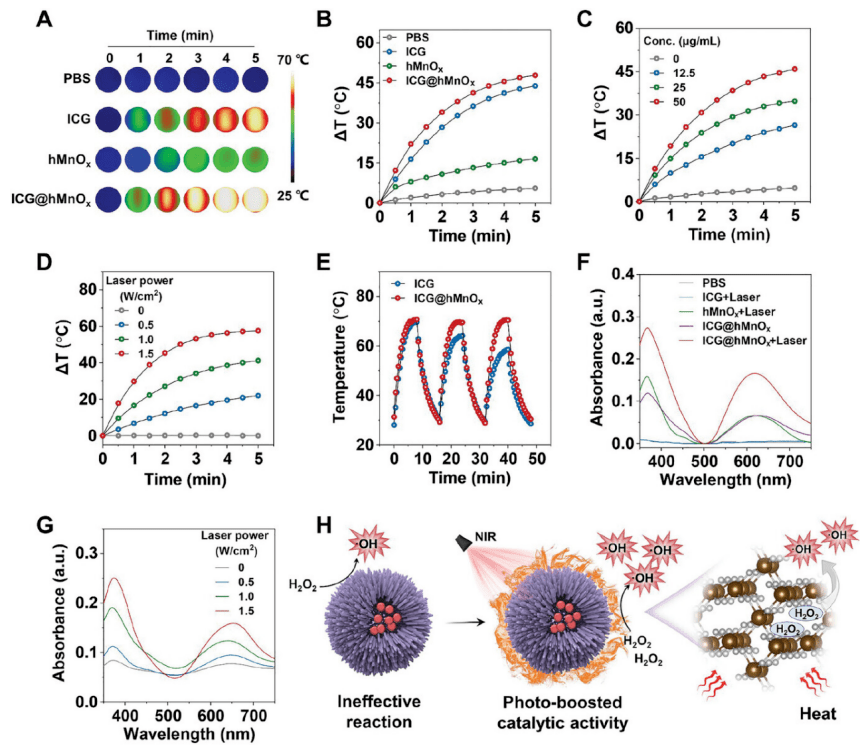
那么, 的“实战”能力如何?针对此,课题组开展光增强的抗菌研究、以及抗生物膜活性的研究。
耐药金葡萄球菌具有耐甲氧西林的特点,因此该团队以其作为模型菌株,研究了 的抗菌活性。在激光照射之下,他们发现 可以显著抑制菌落形成、破坏金葡萄球菌的细胞结构并清除金葡萄球菌。
单一来看, 的光热效应抗菌活性并不算强,这说明它的抗菌效果在很大程度上依赖于自身的催化活性。

结果发现: 与金葡萄球菌生物膜共同孵育之后, 能够渗透进生物膜深处,而且两者的荧光信号呈现出明显的共定位。
即便在电子显微镜下,也能观察到纳米粒粘附在细菌表面。由此可见, 具有强大的生物膜渗透能力以及细菌捕获能力。
另外,经过 处理之后的金葡萄球菌细胞膜会被严重破坏,表现出膜电位丧失以及膜去极化的现象,这表明 可以通过光热增强的类纳米酶活性,充当膜表面锚定的活性氧生成器。
作为一种内源性抗氧化防御物质,谷胱甘肽可以避免氧化应激来对细菌和细胞进行破坏,进而规避治疗效果的降低。
因此,课题组也研究了 对谷胱甘肽的作用。结果发现:在激光照射之下, 可以加速谷胱甘肽的消耗。
总体而言,以上结果证实在激光照射之下, 可以多方面地对抗金葡萄球菌生物膜感染,比如对抗生物膜渗透、细菌捕获和谷胱甘肽消耗等。

针对此类伤口模型,当治疗条件不同时,治疗效果也不尽相同。具体来说,当 结合激光照射治疗时,伤口表现出更快的愈合速度、以及更少的细菌负荷。
随后,他们发现治疗之后的伤口部位,多种炎症因子的表达均得到显著降低,血管生成标志物明显升高,伤口血氧饱和度明显改善,且有大量的胶原沉积和皮肤附属物形成,这表明经过氧气和营养补充之后, 能够促进伤口修复与再生。

下一步,他们将继续聚焦精准高效抗菌纳米酶的开发,从根本上解决细菌壁粘附性和生物被膜穿透性相互制约的问题。
另外,由于缺乏合适的诊疗一体化探针,目前还难以实现深部组织器官感染的及时干预和早期诊断。结合课题组在磁共振成像、光声成像和抗菌纳米酶等方面的经验和基础,针对难治性深部组织的细菌感染开发精准诊疗一体化探针,也是他们打算着力攻克的一个难题。
上一篇:疗养院一体化MBR废水处理设备 下一篇:沈阳药科大学郭春课题组在小分子化合物抗耐药真菌研究